-
![[image]](https://www.balancer.ru/cache/sites/ua/ts/tsn/image/media/images3/550xX/Mar2014/128x128-crop/383961030.jpg)
Новости медицины
Перенос из темы «Новости биологии»Теги:

Handheld skin printer proves itself a healer in severe burns trial
In search of new ways to treat severe burns that don’t involve skin grafts, scientists at the University of Toronto have spent more than a decade developing a portable device that can print out large sheets of "bio ink" to boost the healing process. The team has put its latest model through trials,… // newatlas.comПоследняя разработка — ручной принтер — позволяет буквально напечатать на теле новый слой кожи, способствуя ускоренному выздоровлению.

assets.newatlas.com
// https://assets.newatlas.com/dims4/default/.../strip/true/crop/1140x760 0 0/resize/1200x800!/quality/90/?url=https://assets.newatlas.com/de/51/9bad07544321be02b6b0d17337f2/49455988086-d971208948-o.jpgУстройство было разработано на факультете прикладной науки и техники Университета Торонто. Учёные надеются создать альтернативную терапию кожным трансплантатам, часто используемым для лечения тяжёлых ожогов, когда кожу со здоровых участков тела пересаживают на повреждённые.
Небольшой ручной принтер печатает листы биоматериала, содержащие клетки мезенхимальной стромы, а также стволовые клетки, которые содействуют регенерации кожи и минимизации рубцов. Медики сообщают, что им удаётся полностью закрыть рану за две минуты, или даже меньше, в зависимости от её размера и сложности ожога.
«Раньше мы доказывали, что можем наносить клетки на ожог, но не было никаких доказательств того, что были какие-либо преимущества в заживлении ран — теперь мы это продемонстрировали», — с уверенностью говорят учёные.
В настоящее время испытания проходят на свиньях, у которых были повреждены как внешние, так и внутренние слои кожи. Исследователи уже доказали, что напечатанные листы способствуют репопуляции дермальных клеток и образованию новых кровеносных сосудов. Команда исследователей планирует продолжить работу над технологией, надеясь, что аппарат может начать использоваться в медицинской практике уже в ближайшие 5 лет.
«Как только он будет использован в операционной, я думаю, этот принтер изменит правила игры при спасении жизней. С таким устройством мы можем полностью изменить практику лечения ожогов и травм», — говорят медики.


Bredonosec> «Как только он будет использован в операционной, я думаю, этот принтер изменит правила игры при спасении жизней. С таким устройством мы можем полностью изменить практику лечения ожогов и травм», — говорят медики.
Девайс конечно зачетный. НО:
-не вижу смысла печатать прямо на больном, зачем? Почему нельзя распечатать отдельно и подсадить?
-эта методика ни ожогового шока, ни ожоговой токсемии не отменяет - а это ~80%
умерших...
Девайс конечно зачетный. НО:
-не вижу смысла печатать прямо на больном, зачем? Почему нельзя распечатать отдельно и подсадить?
-эта методика ни ожогового шока, ни ожоговой токсемии не отменяет - а это ~80%
умерших...


Wyvern-2> -не вижу смысла печатать прямо на больном, зачем? Почему нельзя распечатать отдельно и подсадить?
может смысл в полимеризации прямо на ране?
Чотб не шить, не клеить, не создавать заранее, а как в детстве клей БФ - просто на рану налить?
Wyvern-2> -эта методика ни ожогового шока, ни ожоговой токсемии не отменяет - а это ~80% умерших...
не, так понятно, что не чудеса и не живая вода.. но всё же
может смысл в полимеризации прямо на ране?
Чотб не шить, не клеить, не создавать заранее, а как в детстве клей БФ - просто на рану налить?
Wyvern-2> -эта методика ни ожогового шока, ни ожоговой токсемии не отменяет - а это ~80% умерших...
не, так понятно, что не чудеса и не живая вода.. но всё же



Раменский приборостроительный завод выпустил опытную партию инновационных противомикробных масок-респираторов, оснащённых технологией очистки воздуха TIOKRAFT. Конструкторы концерна стали первыми в мире, кому удалось использовать фотокаталитические фильтры для производства средств индивидуальной защиты.
Маски
По заявлению компании, разработанная защитная маска способна препятствовать попаданию в дыхательные пути человека любых микроорганизмов и бактерий, включая туберкулёзную палочку, споры плесени, грибов, бактерий и летучих органических соединений. Борется маска и с неприятными запахами органической природы, а также способна защитить от опасных вирусов, которые распространяются воздушно-капельным путём.
«Это наша инициативная разработка, которая уже интересна потенциальным заказчикам из медицины и промышленности. Сегодня существует два варианта производства. В первом случае используется аккумулятор, который питает УФ-элемент, расщепляющий вредные примеси. Такие маски могут использоваться в тяжёлых условиях эксплуатации, например инфекционных отделениях или химическом производстве. Во втором случае фотокаталитический фильтр просто задерживает на своей поверхности микроорганизмы, а на ночь маска кладётся в специальный обеззараживающий бокс и через восемь часов снова готова к работе», — первый заместитель генерального директора КРЭТ Владимир Зверев.
Главной особенностью маски стал работающий по технологии фотокатализа фильтр. Он способен ускорять химическую реакцию разложения органических соединений. В качестве катализатора используется диоксид титана и источник ультрафиолетового света мягкого диапазона. Механизм работы маски следующий: фильтр задерживает вредные примеси, а под действием ультрафиолета он расщепляется на воду и углекислый газ.
Производством масок-респираторов занимается Раменский приборостроительный завод. Представители предприятия отметили, что готовы приступить к серийному производству

Маски
По заявлению компании, разработанная защитная маска способна препятствовать попаданию в дыхательные пути человека любых микроорганизмов и бактерий, включая туберкулёзную палочку, споры плесени, грибов, бактерий и летучих органических соединений. Борется маска и с неприятными запахами органической природы, а также способна защитить от опасных вирусов, которые распространяются воздушно-капельным путём.
«Это наша инициативная разработка, которая уже интересна потенциальным заказчикам из медицины и промышленности. Сегодня существует два варианта производства. В первом случае используется аккумулятор, который питает УФ-элемент, расщепляющий вредные примеси. Такие маски могут использоваться в тяжёлых условиях эксплуатации, например инфекционных отделениях или химическом производстве. Во втором случае фотокаталитический фильтр просто задерживает на своей поверхности микроорганизмы, а на ночь маска кладётся в специальный обеззараживающий бокс и через восемь часов снова готова к работе», — первый заместитель генерального директора КРЭТ Владимир Зверев.
Главной особенностью маски стал работающий по технологии фотокатализа фильтр. Он способен ускорять химическую реакцию разложения органических соединений. В качестве катализатора используется диоксид титана и источник ультрафиолетового света мягкого диапазона. Механизм работы маски следующий: фильтр задерживает вредные примеси, а под действием ультрафиолета он расщепляется на воду и углекислый газ.
Производством масок-респираторов занимается Раменский приборостроительный завод. Представители предприятия отметили, что готовы приступить к серийному производству

КРЭТ готов к серийному производству инновационных противомикробных масок
Раменский приборостроительный завод, входящий в «Концерн Радиоэлектронные технологии» Госкорпорации Ростех, выпустил опытную партию инновационных противомикробных масок-респираторов с технологией очистки воздуха TIOKRAFT. Конструкторам концерна единственным в мире удалось решить задачу по интеграции фотокаталитических фильтров в средства индивидуальной защиты. Защитная маска эффективна против любых типов микроорганизмов, включая туберкулезную палочку, а также спор плесени и грибов, бактерий, любых летучих органических соединений и неприятных запахов органической природы. // Дальше — rostec.ru

Новость старая, но идея интересная.


Narrow-spectrum UV light may reduce surgical infections
Despite major efforts to keep operating rooms sterile, surgical wound infections remain a serious and stubborn problem, killing up to 8,200 patients a year in the U.S. A study by Columbia University Medical Center (CUMC) researchers suggests that narrow-spectrum ultraviolet (UV) light could dramatically reduce such infections without damaging human tissue. The study, conducted in tissue culture, was published today in the journal PLOS ONE. // medicalxpress.com


Найден способ вырастить потерянные зубы
Ученые Киотского университета и Университета Фукуи в Японии нашли генетический механизм, который может помочь регенерации новых коренных зубов взамен утерянных. Оказалось, что антитела к гену USAG-1 могут стимулировать рост зубов у мышей, страдающих врожденным агенезом зубов. // lenta.ruУченые Киотского университета и Университета Фукуи в Японии нашли генетический механизм, который может помочь регенерации новых коренных зубов взамен утерянных. Об этом сообщается в статье, опубликованной в журнале Science Advances. Кратко о научной работе рассказывается в пресс-релизе на MedicalXpress.
Исследователи показали, что антитела к гену USAG-1 (ген, связанный с сенсибилизацией матки, — прим. «Ленты.ру») могут стимулировать рост зубов у мышей, страдающих врожденным агенезом зубов.
Известно, что морфогенез отдельных зубов зависит от взаимодействий нескольких молекул, включая костный морфогенетический белок (BMP) и элементы сигнального пути Wnt.BMP и Wnt, регулирующие развитие человеческого зародыша, поэтому препараты, влияющие на их активность, могут нарушить важные процессы в организме. Поэтому ученые нацелились на те молекулы, которые подавляют сигнальные факторы, что, как предполагается, более безопасно.
USAG-1 взаимодействует как с BMP, так и с Wnt. Воздействие различных антител на USAG-1 привело к низким показателям рождаемости и выживаемости мышей. Однако одно из антител нарушило взаимодействие гена только с BMP, что позволило вырастить полноценный зуб без вреда для здоровья.
Так-то понятно, что какой-то способ просто обязан быть - достаточно вспомнить тератомы (не к ночи, ессно).


Fakir> Найден способ вырастить потерянные зубы: Наука: Наука и техника: Lenta.ru
Илья Иосифович еще полвека назад всё украл )

Илья Иосифович еще полвека назад всё украл )

Читать Биотоки, биотоки - Варшавский Илья Иосифович - Страница 1 - читать онлайн
Читать книгу Биотоки, биотоки. Автор Варшавский Илья Иосифович. Бесплатно читать книги популярного автора Варшавский Илья Иосифович онлайн. Без регистрации и без смс в онлайн библиотеке. Страница 1. online-knigi.com.ua. // online-knigi.com.ua


Радиация против аритмии
Желудочковую тахикардию можно сильно ослабить радиационным ударом по сердцу. // www.nkj.ru

Учёные создали растворимый пластырь от облысения
Андрогенетическая алопеция считается самой распространённой причиной потери волосяного покрова у мужчин и женщин. Китайские учёные создали пластырь, который смог вылечить облысение в два раза быстрее современных лекарственных препаратов.
При андрогенетической алопеции волосы выпадают в районе лба, висков и макушки. Это происходит из-за разрушения волосяных луковиц (фолликулов), а первопричиной считаются гормональные изменения. Обычно для решения проблемы используют препараты на основе миноксидила, но изобретение китайских исследователей позволило добиться более впечатляющих результатов.
Пластырь до и после использования
Пластырь содержит микроиглы из гиалуроновой кислоты с наночастицами церия, покрытые биоразлагаемым соединением. Во время эксперимента его наклеивали на проплешины первой группы самцов мышей, в то время как контрольная группа получала традиционное лечение миноксидилом. Уже через 28 дней у всех мышек обнаружилось полное восстановление волосяного покрова. Вот только пластырь сделал это в два раза быстрее, поскольку уже на второй неделе под его воздействием стали образовываться новые кровеносные сосуды в коже и волосяные луковицы.
Образование волосяных луковиц
По мнению учёных, пластыри с наночастицами церия представляет собой многообещающий способ обратить облысение вспять. Впереди испытания на людях, однако нужно правильно рассчитать дозировки, так как человеку нужно больше действующего вещества.

Андрогенетическая алопеция считается самой распространённой причиной потери волосяного покрова у мужчин и женщин. Китайские учёные создали пластырь, который смог вылечить облысение в два раза быстрее современных лекарственных препаратов.
При андрогенетической алопеции волосы выпадают в районе лба, висков и макушки. Это происходит из-за разрушения волосяных луковиц (фолликулов), а первопричиной считаются гормональные изменения. Обычно для решения проблемы используют препараты на основе миноксидила, но изобретение китайских исследователей позволило добиться более впечатляющих результатов.
Пластырь до и после использования
Пластырь содержит микроиглы из гиалуроновой кислоты с наночастицами церия, покрытые биоразлагаемым соединением. Во время эксперимента его наклеивали на проплешины первой группы самцов мышей, в то время как контрольная группа получала традиционное лечение миноксидилом. Уже через 28 дней у всех мышек обнаружилось полное восстановление волосяного покрова. Вот только пластырь сделал это в два раза быстрее, поскольку уже на второй неделе под его воздействием стали образовываться новые кровеносные сосуды в коже и волосяные луковицы.
Образование волосяных луковиц
По мнению учёных, пластыри с наночастицами церия представляет собой многообещающий способ обратить облысение вспять. Впереди испытания на людях, однако нужно правильно рассчитать дозировки, так как человеку нужно больше действующего вещества.

Attention Required! | Cloudflare
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property. If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware. If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices. Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store. // Дальше — 4pda.to

Медики случайно создали вакцину от ревматоидного артрита
Один из представителей Университета Толедо изучал 14-3-3 дзета белок с целью выявления его роли в иммунных заболеваниях. В какой-то момент он пришёл к неверным теоретическим выводам, что привело к развитию тяжёлого артрита у подопытных животных, к которым применялось редактирование генов. Используя эти данные, группа исследователей решила попытаться сделать из очищенной версии белка вакцину. Каково же было их удивление, когда вакцина вызвала быстрый и продолжительный иммунный ответ у животных. Также удалось обнаружить полное исчезновение ранее существовавшего артрита.
Экспериментальная вакцина улучшила качество костей, что существенно расширяет область её применения. В настоящее время команда ищет партнёров среди фармацевтических компаний, чтобы начать доклинические испытания и вывести вакцину на рынок.
Один из представителей Университета Толедо изучал 14-3-3 дзета белок с целью выявления его роли в иммунных заболеваниях. В какой-то момент он пришёл к неверным теоретическим выводам, что привело к развитию тяжёлого артрита у подопытных животных, к которым применялось редактирование генов. Используя эти данные, группа исследователей решила попытаться сделать из очищенной версии белка вакцину. Каково же было их удивление, когда вакцина вызвала быстрый и продолжительный иммунный ответ у животных. Также удалось обнаружить полное исчезновение ранее существовавшего артрита.
Экспериментальная вакцина улучшила качество костей, что существенно расширяет область её применения. В настоящее время команда ищет партнёров среди фармацевтических компаний, чтобы начать доклинические испытания и вывести вакцину на рынок.



В США врачи пересадили человеку сердце генетически модифицированной свиньи
Американские врачи успешно пересадили 57-летнему Дэвиду Беннетту сердце генетически модифицированной свиньи, сообщает The New York Times. // www.interfax.ruВ США врачи пересадили человеку сердце генетически модифицированной свиньи
Москва. 11 января. INTERFAX.RU - Американские врачи успешно пересадили 57-летнему Дэвиду Беннетту сердце генетически модифицированной свиньи, сообщает The New York Times. Это первая успешная трансплантация свиного сердца человеку.
Как отмечается, восьмичасовая операция была проведена в Балтиморе в пятницу. По словам хирургов Медицинского центра Университета Мэриленда, в понедельник пациент чувствовал себя хорошо. Он пока еще подключен к аппарату искусственного кровообращения, но новое сердце функционирует и уже выполняет большую часть работы.
Издание предупреждает, что прогноз для пациента еще не ясен, но указывает, что в наиболее опасные 48 часов после операции отторжение донорского сердца не произошло.


мож, конечно, и рекламят, но, читая комментарии, не заметил опровержений заявленного....
Новое исследование, опубликованное в журнале Sleep Health Journal, осветило возможности смарт-часов Samsung Galaxy Watch4, связанные с измерением обструктивного апноэ во сне. Оказалось, что гаджет южнокорейского бренда не уступает в точности диагностики современному медицинскому оборудованию.
Согласно результатам, Galaxy Watch4 соответствует стандартам FDA и ISO. При исследовании смарт-часы имели общую среднеквадратичную ошибку (RMSE) 2,3% и незначительное смещение -0,2%, а график плотности Бланда-Альтмана показал хорошее соответствие между смарт-часами Samsung и эталонным пульсоксиметром. Более того, устройство южнокорейского бренда повысило точность измерений SpO2 за счёт плотного прилегания к запястью.
В сравнении приняли участие 97 взрослых с нарушениями сна, а весь эксперимент курировали семь медицинских работников. Исследование проводилось в медицинском центре Samsung. И хотя точностью датчиков для пульсоксиметрии в современных носимых устройствах сейчас мало кого можно удивить, это не отменяет того факта, что отслеживание апноэ во сне — труднопроводимая диагностика, которую необходимо проводить в течение множества ночей в больнице, а смарт-часы позволят это сделать с комфортом в собственной кровати.


где-то была тема про физиотерапию, но не нахожу...
Африканские ученые нашли метод лечения поверхностных язв от диабета, являющихся наиболее частой причиной нетравматических ампутаций ног по причине занесения инфекций.
Они наклеивают на рану электрод, второй - вокруг раны. Электроды гибкие и растягивающиеся. Периодическая электростимуляция провоцирует миграцию здоровых клеток кожи в язву и быстрейшее заживление. На 30-50% более быстрое.
First bioresorbable electronic bandage speeds healing by 30%
Northwestern University researchers have developed a first-of-its-kind small, flexible, stretchable bandage that accelerates healing by delivering electrotherapy directly to the wound site. In an animal study, the new bandage healed diabetic ulcers 30% faster than in mice without the bandage. Read the full story for more information: https://news.northwestern.edu/stories/2023/02/first-transient-electronic-bandage-speeds-healing-by-30/ ____ ▶️ Subscribe: https://bit.ly/NorthwesternUYTSubscribe Follow Northwestern on social media: -Instagram: https://instagram.com/northwesternu -TikTok:…
Одна сторона содержит интеллектуальную регенеративную систему, а другая — катушку для сбора энергии для питания системы, а также чип NFC для беспроводной передачи данных.
по прошествии времени центральная часть, находящаяся в ране, биоразлагается без следов, снимая вопрос удаления электрода из толщи кожи.
Африканские ученые нашли метод лечения поверхностных язв от диабета, являющихся наиболее частой причиной нетравматических ампутаций ног по причине занесения инфекций.
Они наклеивают на рану электрод, второй - вокруг раны. Электроды гибкие и растягивающиеся. Периодическая электростимуляция провоцирует миграцию здоровых клеток кожи в язву и быстрейшее заживление. На 30-50% более быстрое.
First bioresorbable electronic bandage speeds healing by 30%
Northwestern University researchers have developed a first-of-its-kind small, flexible, stretchable bandage that accelerates healing by delivering electrotherapy directly to the wound site. In an animal study, the new bandage healed diabetic ulcers 30% faster than in mice without the bandage. Read the full story for more information: https://news.northwestern.edu/stories/2023/02/first-transient-electronic-bandage-speeds-healing-by-30/ ____ ▶️ Subscribe: https://bit.ly/NorthwesternUYTSubscribe Follow Northwestern on social media: -Instagram: https://instagram.com/northwesternu -TikTok:…
Одна сторона содержит интеллектуальную регенеративную систему, а другая — катушку для сбора энергии для питания системы, а также чип NFC для беспроводной передачи данных.
по прошествии времени центральная часть, находящаяся в ране, биоразлагается без следов, снимая вопрос удаления электрода из толщи кожи.


эндоскопы, меняющие форму внутри тела
How to make self-folding surgical tools
For minimally invasive surgery, devices need to be small. ETH researchers have now developed a method to transport large devices through a narrow catheter. This expands the possibilities for designing minimally invasive surgical devices. - - - ETH Social Media Links: Facebook: https://www.facebook.com/eth/ Instagram: https://www.instagram.com/ethzurich/ Twitter: https://twitter.com/eth_en LinkedIn: https://www.linkedin.com/school/eth-zurich/ https://www.ethz.ch
Инструменты MaSoChain представляют собой совокупность небольших жёстких полимерных сегментов, соединённых гибкими эластичными соединителями. Внутри каждого сегмента находится крошечный магнит, расположенный определённым образом, и при введении системы в лапароскопический катетер все компоненты располагаются впритык в ряд, подобно бусинам на нитке.
А когда инструмент выталкивается из конца катетера, магниты притягиваются друг к другу, заставляя его принимать желаемую конфигурацию. После выполнения операции компоненты инструмента снова собираются в нить, и их вытягиваются обратно через катетер. Затем MaSoChain стерилизуется и подготавливается для следующей операции.
При этом можно и получать "пинцеты" для переноса чего-то к чему-то, и не только...
How to make self-folding surgical tools
For minimally invasive surgery, devices need to be small. ETH researchers have now developed a method to transport large devices through a narrow catheter. This expands the possibilities for designing minimally invasive surgical devices. - - - ETH Social Media Links: Facebook: https://www.facebook.com/eth/ Instagram: https://www.instagram.com/ethzurich/ Twitter: https://twitter.com/eth_en LinkedIn: https://www.linkedin.com/school/eth-zurich/ https://www.ethz.ch
Инструменты MaSoChain представляют собой совокупность небольших жёстких полимерных сегментов, соединённых гибкими эластичными соединителями. Внутри каждого сегмента находится крошечный магнит, расположенный определённым образом, и при введении системы в лапароскопический катетер все компоненты располагаются впритык в ряд, подобно бусинам на нитке.
А когда инструмент выталкивается из конца катетера, магниты притягиваются друг к другу, заставляя его принимать желаемую конфигурацию. После выполнения операции компоненты инструмента снова собираются в нить, и их вытягиваются обратно через катетер. Затем MaSoChain стерилизуется и подготавливается для следующей операции.
При этом можно и получать "пинцеты" для переноса чего-то к чему-то, и не только...


First fully robotic lung transplant at Vall d'Hebron - Animation
Vall d'Hebron hospital achieves the first fully robotic lung transplant with a new access route: the new technique has allowed replacing the traditional 30-centimetre incision in the thorax with small incisions of just a few centimetres More: https://vhc.cat/robotic-lung-trasplant
Хирурги университетской больницы Валь-д’Эброн в Барселоне провели первую в мире полностью роботизированную трансплантацию лёгких. По их мнению, четырёхрукий робот «Да Винчи» справился с ней лучше, чем смог бы настоящий персонал.
Пациентом был 65-летний мужчина по имени Ксавьер, нуждающийся в трансплантации лёгкого из-за лёгочного фиброза (когда ткань перестаёт быть эластичной и не может растягиваться). Обычно данная операция включает 30-сантиметровый разрез в грудной клетке и намеренный перелом нескольких рёбер. Это позволяет хирургам получить доступ к органу, удалить его и заменить донорским.
Но с роботом врачи смогли сделать гораздо меньший надрез и обойтись без переломов. Перед операцией воздух из донорского лёгкого убрали, чтобы уменьшить размер органа — это позволило просунуть его в грудную клетку сквозь разрез шириной всего 8 см. Затем сбоку рёбер были сделаны небольшие надрезы для размещения рук робота и 3D-камер, которые дали хирургам 360-градусный обзор внутри полости.
Роботы «Да Винчи» разработаны корпорацией Intuitive Surgical. Система не выполняет операцию сама, а лишь транслирует движения рук хирурга на консоли в режиме реального времени


Есть серьезная надежда, что найдено противоядие против бледной поганки!

До того пробовали использовать как антидот пенициллиновые антибиотики, которые каким-то макаром, видимо как схожие грибные токсины, конкурировали с а-аманитином, но особой эффективности такая терапия не имела.
Если получится - одно из самых стоящих за последнее время медицинских открытий будет. По крайней мере для российских реалий, где сбор грибов весьма популярен и бледная поганка и родственные ей по токсичности грибы - основная причина смерти неудачливых грибников
Ученые обнаружили вещество, которое может стать первым в мире противоядием при отравлении бледной поганкой, являющейся одним из самых смертоносных грибов. Об этом сообщается в статье, опубликованной в журнале Nature Communications.
Исследователи выяснили, что широко используемый медицинский краситель, одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), снижает токсичное действие бледной поганки Amanita phalloides на мышей.
По оценкам, бледные поганки являются причиной более 90 процентов всех смертей от отравления грибами во всем мире, вызывая необратимую острую недостаточность печени и почек. Основным токсином является α-аманитин, который стал целью для нового исследования. Несмотря на его летальный эффект, точные механизмы того, как α-аманитин отравляет людей, остаются неясными, что приводит к отсутствию специфического антидота для лечения.
Ученые использовали полногеномный скрининг с помощью метода CRISPR, чтобы определить гены, ответственные за отравление. Оказалось, что белок STT3B был ключевым виновником токсических эффектов при отравлении аманитином. Его ингибитор, индоцианин зеленый (ICG), можно использовать в качестве специфического антидота. ICG эффективно блокировал токсическое действие α-аманитина на клетки, органоиды печени и самцов мышей, что способствовало общему увеличению выживаемости животных.

Обнаружено противоядие при отравлении самым смертоносным грибом в мире
Исследователи выяснили, что широко используемый медицинский краситель индоцианин зеленый, одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США, снижает токсичное действие бледной поганки Amanita phalloides на мышей, увеличивая выживаемость животных. // lenta.ruДо того пробовали использовать как антидот пенициллиновые антибиотики, которые каким-то макаром, видимо как схожие грибные токсины, конкурировали с а-аманитином, но особой эффективности такая терапия не имела.
Если получится - одно из самых стоящих за последнее время медицинских открытий будет. По крайней мере для российских реалий, где сбор грибов весьма популярен и бледная поганка и родственные ей по токсичности грибы - основная причина смерти неудачливых грибников


Учёные Северо-Западной медицины разработали ультразвуковое устройство, имплантируемое в череп и преодолевающее гематоэнцефалический барьер. Это позволяет проникать в большие критические области человеческого мозга для доставки препаратов для химиотерапии, обычно вводимых внутривенно.
В настоящее время нет эффективного лечения глиобластомы, так как даже самая мощная химиотерапия не может проникнуть через гематоэнцефалический барьер и достичь опухоли. Но команда исследователей попробовала подключить к решению этой проблемы ультразвук. Оказалось, что после использования УЗ и микропузырьков гематоэнцефалический барьер восстанавливается в течение примерно 30–60 минут после проведения лечебной процедуры.
Исследование показало, что ультразвук, открывающий гематоэнцефалический барьер, увеличил концентрацию паклитакселома и карбоплатинома в мозге в 4–6 раз. Данная процедура оказалась безопасна и хорошо переносилась пациентами. Некоторые из них успешно прошли до шести циклов лечения.
«Хотя мы сосредоточились на раке головного мозга, это открывает двери для исследования новых лекарственных средств для лечения миллионов пациентов, страдающих прочими заболеваниями головного мозга», — сказал один из авторов разработки.
В настоящее время нет эффективного лечения глиобластомы, так как даже самая мощная химиотерапия не может проникнуть через гематоэнцефалический барьер и достичь опухоли. Но команда исследователей попробовала подключить к решению этой проблемы ультразвук. Оказалось, что после использования УЗ и микропузырьков гематоэнцефалический барьер восстанавливается в течение примерно 30–60 минут после проведения лечебной процедуры.
Исследование показало, что ультразвук, открывающий гематоэнцефалический барьер, увеличил концентрацию паклитакселома и карбоплатинома в мозге в 4–6 раз. Данная процедура оказалась безопасна и хорошо переносилась пациентами. Некоторые из них успешно прошли до шести циклов лечения.
«Хотя мы сосредоточились на раке головного мозга, это открывает двери для исследования новых лекарственных средств для лечения миллионов пациентов, страдающих прочими заболеваниями головного мозга», — сказал один из авторов разработки.


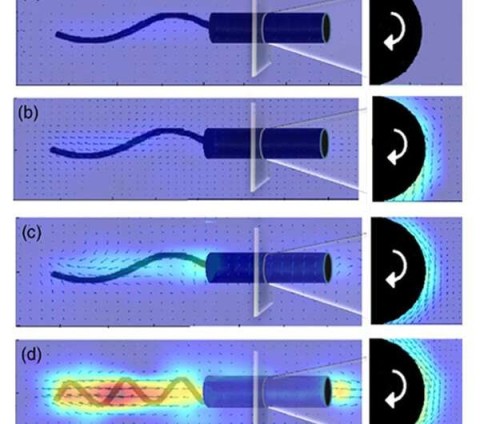
Исследователи инженерного колледжа FAMU-FSU создали трёхмерную модель бактерии Helicobacter pylori, чтобы лучше понять её движение, взломать код, управляющий подвижностью организма, и разработать альтернативные методы лечения связанных с ней инфекций.
Researchers use 3D models to investigate bacteria movement
In a new study FAMU-FSU College of Engineering researchers created a 3D model of this bacteria to better understand its movement, hoping to crack the code governing the organism's motility and develop alternative treatments for infections, such as strengthening the gastric mucus barrier that stands against the bacteria.
Команда поместила модель бактерий в высоковязкий полимерный гель, который ещё называется жидкостью предела текучести — эти жидкости ведут себя как твёрдые тела при небольших напряжениях, но текут как жидкости после критической точки напряжения. Далее учёные использовали магнитное поле, чтобы вращать 3D-модель, имитируя поведение микроорганизма. Используя методы отслеживания частиц и визуализации, они измерили скорость бактерий и визуализировали распределение и плотность жидкости, обтекающей их.
Исследование помогло определить два критических порога, которые должны преодолеть бактерии: крутящий момент, необходимый для вращения плавательной модели, и сила, необходимая для продвижения модели вперёд. Это похоже на вворачивание шурупа в твёрдую стену. Плавающие движения и сила, позволяющие Helicobacter pylori двигаться, также применимы к более крупным объектам, таким как дождевые черви, которые зарываются в почву, различным паразитам и т. д.
Если на основе этой модели не удастся выявить уязвимости вредной бактерии, то, как минимум, по её подобию можно будет разработать двигательный алгоритм для микророботов, доставляющих лекарства в нужные участки организма.
Researchers use 3D models to investigate bacteria movement
In a new study FAMU-FSU College of Engineering researchers created a 3D model of this bacteria to better understand its movement, hoping to crack the code governing the organism's motility and develop alternative treatments for infections, such as strengthening the gastric mucus barrier that stands against the bacteria.
Команда поместила модель бактерий в высоковязкий полимерный гель, который ещё называется жидкостью предела текучести — эти жидкости ведут себя как твёрдые тела при небольших напряжениях, но текут как жидкости после критической точки напряжения. Далее учёные использовали магнитное поле, чтобы вращать 3D-модель, имитируя поведение микроорганизма. Используя методы отслеживания частиц и визуализации, они измерили скорость бактерий и визуализировали распределение и плотность жидкости, обтекающей их.
Исследование помогло определить два критических порога, которые должны преодолеть бактерии: крутящий момент, необходимый для вращения плавательной модели, и сила, необходимая для продвижения модели вперёд. Это похоже на вворачивание шурупа в твёрдую стену. Плавающие движения и сила, позволяющие Helicobacter pylori двигаться, также применимы к более крупным объектам, таким как дождевые черви, которые зарываются в почву, различным паразитам и т. д.
Если на основе этой модели не удастся выявить уязвимости вредной бактерии, то, как минимум, по её подобию можно будет разработать двигательный алгоритм для микророботов, доставляющих лекарства в нужные участки организма.


Команда учёных из Университета Эрланген-Нюрнберг в Германии совершила значительный медицинский прорыв в 3D-печати, создав миниатюрную камеру сердца, которая способна автономно биться более 100 дней.
В ходе эксперимента исследователи использовали кардиомиоциты, коллаген и гиалуроновую кислоту, что позволило создать уникальные «биологические чернила». Затем полученный материал был введён в структуру сердечной ткани на гелиевой основе. После печати гель затвердел, и на выходе была получена сердечная камера, идентичная настоящей.
Стоит отметить, что размеры такой напечатанной модели — всего 14 мм в высоту и 8 мм в диаметре, что составляет одну шестую от камеры настоящего сердца. Несмотря на это, она начала биться всего через неделю после печати и продолжила в течение впечатляющих 100 дней.
В дальнейшем учёные намерены ввести в эти микрокамеры вторые биочернила. Они верят, что этот инновационный подход позволит увеличить количество кровеносных сосудов внутри камер и в конечном счёте позволит напечатать полностью функциональное сердце, что спасёт огромное количество жизней.
В ходе эксперимента исследователи использовали кардиомиоциты, коллаген и гиалуроновую кислоту, что позволило создать уникальные «биологические чернила». Затем полученный материал был введён в структуру сердечной ткани на гелиевой основе. После печати гель затвердел, и на выходе была получена сердечная камера, идентичная настоящей.
Стоит отметить, что размеры такой напечатанной модели — всего 14 мм в высоту и 8 мм в диаметре, что составляет одну шестую от камеры настоящего сердца. Несмотря на это, она начала биться всего через неделю после печати и продолжила в течение впечатляющих 100 дней.
В дальнейшем учёные намерены ввести в эти микрокамеры вторые биочернила. Они верят, что этот инновационный подход позволит увеличить количество кровеносных сосудов внутри камер и в конечном счёте позволит напечатать полностью функциональное сердце, что спасёт огромное количество жизней.


Разработанное ИИ лекарство впервые испытают на людях
Лекарство INS018_055 биотехнологического стартапа Insilico Medicine допущено до испытаний на людях. Глава компании Александр Жаворонков рассказал, что именно лечит данный препарат, а также поделился информацией о том, какой именно ИИ участвовал в его разработке.
Лекарство рассчитано на лечение идиопатического лёгочного фиброза — разновидности пневмонии. Без должной терапии болезнь заканчивается летальным исходом в течение двух лет, а существующие лекарства рассчитаны только на замедление развития заболевания, но не лечение.
По словам Жаворонкова, дизайн и цель (механизм действия) INS018_055 разработаны с помощью искусственного интеллекта, а сам препарат — первое лекарственное средство, созданное с помощью ИИ и дошедшее до второй фазы испытаний с участием тестовых групп по 100–300 добровольцев. Если вторая фаза пройдёт успешно, то тестовые группы увеличат до 1000–3000 участников. Когда эффективность и безвредность INS018_055 будет доказана, он может появиться на полках аптек, но уже под более пригодным для рынка названием.
Лекарство было разработано с помощью нейросети GENTRL (generative tensorial reinforcement learning). Сейчас компания работает над ещё двумя препаратами, созданными с помощью этой же программы. Первый лечит COVID-19 и пока находится на первой фазе испытаний, а второй задумывается как лекарство от рака. Препарат ещё не начали испытывать, но одобрение от американского регулятора FDA уже получено.
Лекарство INS018_055 биотехнологического стартапа Insilico Medicine допущено до испытаний на людях. Глава компании Александр Жаворонков рассказал, что именно лечит данный препарат, а также поделился информацией о том, какой именно ИИ участвовал в его разработке.
Лекарство рассчитано на лечение идиопатического лёгочного фиброза — разновидности пневмонии. Без должной терапии болезнь заканчивается летальным исходом в течение двух лет, а существующие лекарства рассчитаны только на замедление развития заболевания, но не лечение.
По словам Жаворонкова, дизайн и цель (механизм действия) INS018_055 разработаны с помощью искусственного интеллекта, а сам препарат — первое лекарственное средство, созданное с помощью ИИ и дошедшее до второй фазы испытаний с участием тестовых групп по 100–300 добровольцев. Если вторая фаза пройдёт успешно, то тестовые группы увеличат до 1000–3000 участников. Когда эффективность и безвредность INS018_055 будет доказана, он может появиться на полках аптек, но уже под более пригодным для рынка названием.
Лекарство было разработано с помощью нейросети GENTRL (generative tensorial reinforcement learning). Сейчас компания работает над ещё двумя препаратами, созданными с помощью этой же программы. Первый лечит COVID-19 и пока находится на первой фазе испытаний, а второй задумывается как лекарство от рака. Препарат ещё не начали испытывать, но одобрение от американского регулятора FDA уже получено.


Новый способ борьбы с аутоиммунными заболеваниями (и та самая волчанка, ага)

Один из разработчиков метода в лучших традициях экспериментировал на себе:

Новая стратегия против атаки клонов
Для исправления ошибок иммунитета ученые предлагают удалять из организма четыре процента Т-лимфоцитов. Инструмент для этого практически создан, осталось его испытать // monocle.ruОдин из разработчиков метода в лучших традициях экспериментировал на себе:
В клинических исследованиях в числе первых лекарство испытывал один из авторов методики — известный биохимик, ректор РНИМУ им. Пирогова, академик Сергей Лукьянов. Он более 30 лет лечился от анкилозирующего спондилоартрита консервативными методами, которые с разной степенью эффективности снимали суставные боли за счет подавления механизма воспаления, но не останавливали прогресс болезни. Введение антиTRBV-9 практически сразу подействовало на клетки-мишени: целевая популяция клеток стала истощаться, что сопровождалось улучшением состояния пациента в течение трех месяцев.



Генная терапия: встречайте лекарства будущего
Несмотря на законодательные ограничения и пока еще бурные этические дискуссии, инструменты для исправления ошибок в человеческой ДНК начинают внедрять в клиническую практику, в том числе в России. О том, насколько близки мы к победе над «плохой генетикой», — в интервью с генным инженером ... // monocle.ru— Мы используем заместительную генную терапию на основе аденоассоциированных вирусов, которая позволяет доставить здоровую копию гена с помощью одноцепочечной ДНК и восстановить нормальные функции синтеза белка. Экспериментируем также с доставкой мРНК-транскриптов с помощью наночастиц, которые существенно сокращают путь синтеза белка, поскольку мРНК не нужно проникать в ядро клетки, а сразу можно начинать трансляцию и получать намного больше белкового продукта.
Плюсом этих методик является безопасность и минимальное количество побочных эффектов со стороны иммунной системы. Надо учитывать, что доставка ДНК происходит локализованно в клетки конкретного органа и остается только в клетках, получивших вирус. При этом популяция клеток, получивших препарат, может вытесняться популяцией обычных клеток, и эффект со временем может утратиться — если мы имеем дело с клетками крови или печени, которые постоянно делятся и обновляются в организме.
Поэтому большая часть исследований в области генной терапии с помощью ААВ находит свое применение в терапии наследственных ретинопатий (патологические изменения сосудов сетчатки глаза) и нейродегенеративных заболеваний, поскольку клетки нейронов практически не делятся, а клетки сетчатки делятся максимально медленно. Дополнением служит большое разнообразие генетических причин в виде мутаций в 140 генах, которые обусловливают разные формы наследственной слепоты. Таким образом, глаз как многослойная медленно делящаяся система клеток, изолированных от общего иммунитета, является удобной моделью для разработки сотни разных препаратов генной терапии.
Расчет дозы лекарств в генной терапии всегда индивидуален — не зря же ее называют персонифицированной. В случае мышечной дистрофии или спинальной мышечной атрофии, которые, как правило, проявляются уже в детском возрасте, расчет производится на каждый килограмм пациента (1Е14 вирусных частиц на килограмм), что со временем кратно увеличивает стоимость терапии, так как с каждым годом вес ребенка увеличивается минимум на два килограмма из-за общего роста организма. Если для терапии ребенка потребуется 15 литров клеточной жидкости, в каждом миллилитре которой содержится один миллион клеток, то для взрослого эта цифра возрастает в четыре-пять раз. Следовательно, для терапии взрослого нам потребуется биореактор емкостью 100 литров, что равно примерно одному триллиону клеток
В случае офтальмологических заболеваний — амаврозы Лебера, атрофии сетчатки — доза на один глаз фиксирована (1Е13 вирусных частиц на глаз) и также зависит от времени проявления симптомов.
Одна доза — миллион долларов
— Сколько в итоге составляет себестоимость генотерапевтических препаратов и за счет чего она может быть снижена?
— Стоимость генотерапевтических препаратов варьируется от 500 тысяч до двух миллионов долларов за одну дозу (офтальмологические препараты), в наших условиях цена одной наработки биореактора объемом 100 литров составляет один миллион рублей, но стоимость одной дозы варьируется от заболевания. В основном цена формируется исходя из количества используемых расходных материалов для культивирования клеток, систем очистки и выделения ААВ и характеризации препарата.
Так дорого это потому, что сборка вируса — процесс случайный. Только два процента от полученной популяции генетического материала является активной и пригодной для терапии. От этого количества еще 20 процентов теряется на очистке, поэтому в реальности мы получаем всего полтора процента от начального количества генетического материала для сборки. Снижение стоимости возможно при использовании платформы наночастиц, но там намного хуже специфичность доставки в ткани. В апреле этого года мы начали работы по исследованию эффективности доставки разными методами, результаты представим в 2027 году.
— Есть ли побочные эффектны у генной терапии и можно ли их контролировать?
— Основное побочное действие препаратов генной терапии, которое наблюдали на заре развития этого направления, — это гепатотоксичность и выраженный иммунный ответ, но стоит отметить, что данный эффект наблюдали на аденовирусах, которые в шесть раз больше ААВ. Аденоассоциированный вирус обладает размером в 20 нанометров и не распознается иммунной системой при первом введении, однако при повторных возможна выработка нейтрализующих антител. Гепатотоксичность также была значительно снижена, но не исключена полностью, но этот вопрос также проявляется, когда речь идет о системном введении препарата внутривенно в больших дозах.
В итоге суммарный срок разработки нового препарата занимает пять лет в лаборатории и еще пять лет в клинике. Основной проблемой клинических испытаний является небольшая когорта пациентов (в лучшем случае десять тысяч человек, в худшем — пять тысяч человек на всю нашу страну) и сложности реализации третьей фазы клинических испытаний. Поэтому общая тенденция разработки подобных препаратов в мире указывает на то, что после всех стадий клинических испытаний из сотни препаратов одобряется только один или два. Поэтому мы видим такой медленный темп появления новых препаратов — раз в два года.



В России создадут биореактор для выращивания человеческих тканей и органов
Ученые Сеченовского Университета завершили первый этап создания автоматизированного биореактора, который обеспечит созревание костной ткани и связок. // www.techinsider.ruУченые из Сеченовского Университета завершили 1-й этап создания автоматизированного биореактора. Он должен обеспечить созревание костной ткани и связок.
Инновационный многоячеистый биореактор позволяет врачам буквально создавать органы «на заказ».


- Последние действия над темой
- Balancer [13.04.2015 03:52]: Тема создана из Новости биологии
- Balancer [13.04.2015 03:52]: Перенос сообщений из Новости биологии
- Balancer [27.11.2016 10:46]: Перенос сообщений в Современная генетика
- Все действия над темой
Copyright © Balancer 1997..2025
Создано 21.10.2014
Связь с владельцами и администрацией сайта: anonisimov@gmail.com, rwasp1957@yandex.ru и admin@balancer.ru.
Создано 21.10.2014
Связь с владельцами и администрацией сайта: anonisimov@gmail.com, rwasp1957@yandex.ru и admin@balancer.ru.
 wolff1975
wolff1975


 инфо
инфо инструменты
инструменты Bredonosec
Bredonosec



 Wyvern-2
Wyvern-2

 Fakir
Fakir



 кщееш
кщееш

 Bredonosec
Bredonosec




 Fakir
Fakir
 Fakir
Fakir
